Original Source : http://www.tulane.edu/~wiser/protozoology/notes/intes.html
Numerosos protozoos habitan en el tracto gastrointestinal de los humanos (véase el recuadro). Esta lista incluye representantes de muchos grupos protozoarios diversos. La mayoría de estos protozoos son comensales no patógenos, o solo resultan en una enfermedad leve. Algunos de estos organismos pueden causar enfermedades graves bajo ciertas circunstancias. Por ejemplo, Giardia lamblia puede causar diarrea aguda severa que puede llevar a una diarrea crónica y trastornos nutricionales; Entamoeba histolytica puede convertirse en un organismo altamente virulento e invasivo que causa una enfermedad sistémica potencialmente letal. Las especies de apicomplexa y microsporidia (discutidas en otra parte), que normalmente no provocan una enfermedad grave, pueden causar diarrea grave y potencialmente mortal en pacientes con SIDA y otras personas inmunocomprometidas. Trichomonas vaginalis no reside en el tracto gastrointestinal, pero a menudo se discute con los flagelados intestinales. Infecta el tracto urogenital y causa una enfermedad de transmisión sexual.
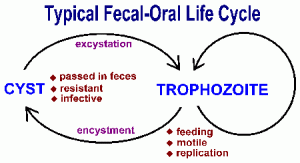 Los protozoos intestinales se transmiten por vía fecal-oral y tienden a exhibir ciclos de vida similares que consisten en una etapa de quiste y una etapa de trofozoíto (Figura). La transmisión fecal-oral implica la ingestión de alimentos o agua contaminada con quistes. Después de ser ingeridos por un huésped apropiado, los quistes se transforman en trofozoitos que exhiben un metabolismo activo y usualmente son móviles. El parásito absorbe nutrientes y sufre una replicación asexual durante la fase trófica. Algunos de los trofozoitos se convertirán en quistes en lugar de someterse a la replicación. Los quistes se caracterizan por una pared resistente y se excretan con las heces. Las funciones de la pared del quiste protegen al organismo de la desecación en el medio ambiente externo, ya que el parásito sufre un período relativamente inactivo a la espera de ser ingerido por el siguiente huésped. Los factores que aumentan la probabilidad de ingerir material contaminado con material fecal desempeñan un papel en la transmisión de este protozoo intestinal (ver Cuadro). En general, las situaciones que involucran el contacto humano-humano cercano y las condiciones antihigénicas promueven la transmisión.
Los protozoos intestinales se transmiten por vía fecal-oral y tienden a exhibir ciclos de vida similares que consisten en una etapa de quiste y una etapa de trofozoíto (Figura). La transmisión fecal-oral implica la ingestión de alimentos o agua contaminada con quistes. Después de ser ingeridos por un huésped apropiado, los quistes se transforman en trofozoitos que exhiben un metabolismo activo y usualmente son móviles. El parásito absorbe nutrientes y sufre una replicación asexual durante la fase trófica. Algunos de los trofozoitos se convertirán en quistes en lugar de someterse a la replicación. Los quistes se caracterizan por una pared resistente y se excretan con las heces. Las funciones de la pared del quiste protegen al organismo de la desecación en el medio ambiente externo, ya que el parásito sufre un período relativamente inactivo a la espera de ser ingerido por el siguiente huésped. Los factores que aumentan la probabilidad de ingerir material contaminado con material fecal desempeñan un papel en la transmisión de este protozoo intestinal (ver Cuadro). En general, las situaciones que involucran el contacto humano-humano cercano y las condiciones antihigénicas promueven la transmisión.
TEMAS:
- Ciclo de vida y morfología
- El disco adhesivo
- Síntomas y Patogenia
- Diagnóstico
- Tratamiento y control
- Tricomoniasis
- Dientamoeba fragilis
- Balantidosis
- Amebiasis
- Blastocystis hominis
- Comensales no patógenos
GIARDIASIS
Giardia lamblia (también conocida como G. duodenalis, ver comentarios sobre taxonomía) es un parásito protozoario que coloniza las porciones superiores del intestino delgado. Tiene una distribución mundial y es el protozoo más común aislado de las heces humanas. La incidencia se estima en 200 millones de casos clínicos por año. De hecho, probablemente fue el primer protozoo simbiótico observado. Es muy probable que Van Leeuwenhoek, el inventor del microscopio, describiera por primera vez a Giardia en 1681 en sus propias heces basándose en su descripción de su movimiento característico. Sin embargo, van Leeuwenhoek nunca presentó dibujos de los organismos y Lambl generalmente recibe crédito por la identificación de Giardia en las heces de pacientes pediátricos en Praque en 1859.
Típicamente, la Giardia no es invasiva y con frecuencia resulta en infecciones asintomáticas. La giardiasis sintomática se caracteriza por diarrea aguda o crónica y / u otras manifestaciones gastrointestinales.
Ciclo vital y morfología
Giardia exhibe un ciclo típico de transmisión fecal-oral (ver arriba). La infección se adquiere a través de la ingestión de quistes. Los factores que conducen a la contaminación de los alimentos o el agua con material fecal se correlacionan con la transmisión (Cuadro). Por ejemplo, la giardiasis es especialmente prevalente en niños y particularmente en niños en instituciones o guarderías. En los países en desarrollo, el saneamiento deficiente contribuye a los niveles más altos de giardiasis, y también se han documentado brotes transmitidos por el agua debido a un tratamiento inadecuado del agua. Se cree que los mochileros en áreas donde no hay viviendas humanas se adquieren al beber de corrientes y algunos datos sugieren que los castores son el reservorio. Sin embargo, la transmisión zoonótica de Giardia es controvertida y no se ha demostrado de forma inequívoca. No está claro si Giardia lamblia representa una sola especie capaz de infectar a una amplia gama de animales, o si cada huésped tiene su propia Giardia “mascota”. La evidencia que indica que la transmisión de Giardia entre perros y humanos es bastante rara favorece esta última. La evidencia molecular sugiere que algunos aislamientos exhiben rangos de host estrechos, mientras que otros exhiben rangos de host amplios (ver notas sobre taxonomía). Independientemente de si es posible la transmisión zoonótica, la transmisión de persona a persona es el modo de transmisión más frecuente y los factores de riesgo son el contacto humano cercano combinado con condiciones antihigiénicas.
El quiste ingerido pasa a través del estómago y la excistación tiene lugar en el duodeno. Excystation puede ser inducida in vitro por una breve exposición de los quistes a pH ácido (~ 2) u otras fuentes de iones de hidrógeno. Esta exposición al pH ácido imita las condiciones del estómago y probablemente funciona como una señal ambiental para el parásito. La actividad flagelar comienza en 5-10 minutos después del tratamiento con ácido y el trofozoíto emerge a través de una ruptura en la pared del quiste. Se cree que la descomposición de la pared del quiste está mediada por proteasas. El trofozoíto se someterá a una citocinesis (división celular sin replicación nuclear) dentro de los 30 minutos posteriores a la salida del quiste, lo que dará como resultado dos trofozoitos binucleados.
El quiste ingerido pasa a través del estómago y la excistación tiene lugar en el duodeno. Excystation puede ser inducida in vitro por una breve exposición de los quistes a pH ácido (~ 2) u otras fuentes de iones de hidrógeno. Esta exposición al pH ácido imita las condiciones del estómago y probablemente funciona como una señal ambiental para el parásito. La actividad flagelar comienza en 5-10 minutos después del tratamiento con ácido y el trofozoíto emerge a través de una ruptura en la pared del quiste. Se cree que la descomposición de la pared del quiste está mediada por proteasas. El trofozoíto se someterá a una citocinesis (división celular sin replicación nuclear) dentro de los 30 minutos posteriores a la salida del quiste, lo que dará como resultado dos trofozoitos binucleados.
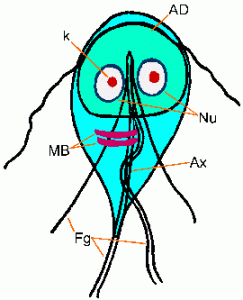
El trofozoíto de Giardia exhibe una forma característica de pera, o lágrima, con simetría bilateral cuando se ve desde la parte superior (Figura). Normalmente tiene una longitud de 12-15 µm, una anchura de 5-10 µm y un espesor de 2-4 µm. Las características del trofozoíto teñido incluyen: dos núcleos (Nu) con cariosomas centrales (k), fibrillas que recorren la longitud del parásito y cuerpos medianos (MB). El gran cariosoma y la falta de cromatina periférica le dan a los núcleos una apariencia de halo. Las fibrillas se denominan axonemas (Ax) y se forman a partir de las regiones proximales de los flagelos (Fg) dentro del cuerpo del trofozoíto. Los cuerpos medianos son un par de estructuras en forma de varilla curvadas que se encuentran en la parte posterior de los núcleos. A nivel ultraestructural, los cuerpos medianos contienen una serie de microtúbulos. La función de los cuerpos medianos no se conoce, pero la mayoría cree que están involucrados de alguna manera con el disco adhesivo y su formación. Un disco adhesivo (AD), no siempre visible por microscopía de luz, ocupa el lado ventral del extremo anterior.
Los trofozoitos de Giardia poseen cuatro pares de flagelos y son móviles. Tres pares de flagelos emergen de la superficie dorsal (anterior, posterior-lateral, caudal) y un par emerge de la superficie ventral. Los trofozoitos exhiben un movimiento de torsión errático distintivo, a veces comparado con el de una hoja que cae. Sin embargo, los trofozoitos se encuentran predominantemente unidos a las células epiteliales del intestino delgado (especialmente el duodeno y el yeyuno) y rara vez se encuentran en las heces, excepto en los casos de diarrea grave. Esta unión al epitelio intestinal está mediada por un orgánulo en el lado ventral del parásito denominado disco adhesivo (ver más abajo). El trofozoíto absorbe los nutrientes de la luz intestinal a través de pinocitosis y no se han descrito organelos de alimentación especializados.
La etapa trófica también se caracteriza por una replicación asexual. Ambos núcleos se dividen aproximadamente al mismo tiempo y la citocinesis restaura el estado binucleado. Cada célula hija recibe una copia de cada núcleo. Ambos núcleos parecen iguales en lo que respecta a la expresión génica y otras propiedades.
Como alternativa a la replicación, el trofozoíto puede enquistarse. Durante el encistramiento, el parásito se redondea, se separa del epitelio intestinal y secreta una pared de quiste. La encistación también se puede realizar in vitro. La inducción óptima del enquistamiento se obtiene privando a los trofozoitos de la bilis a pH 7, seguido de una exposición a altas concentraciones de bilis a pH 7,8. La falta de bilis a pH neutro imita las condiciones bajo la capa de moco adyacente a las células epiteliales intestinales, mientras que la exposición a altas concentraciones de bilis a pH más alcalino es análoga a la luz intestinal. Estos estudios resaltan hasta qué punto Giardia se ha adaptado a la vida dentro del tracto gastrointestinal.
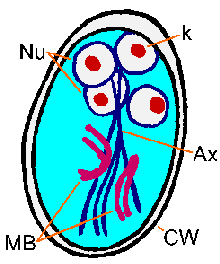
Los estudios moleculares y ultraestructurales revelan la síntesis de proteínas de la pared del quiste y la aparición de grandes vesículas secretoras en el citoplasma del parásito después de la inducción del encistramiento. Después de la formación de la pared del quiste, el parásito experimenta una ronda de división nuclear sin citoquinesis que da como resultado cuatro núcleos. Estos cuatro núcleos (Nu) generalmente se ubican en el extremo anterior del quiste (Figura). Los flagelos y el disco adhesivo se pierden a medida que el quiste madura, pero los axonemas (Ax) y los cuerpos medianos (MB) persisten. Las fibrillas distintivas (es decir, los axonemas), que se extienden a lo largo del quiste, hacen que Giardia sea relativamente fácil de identificar sin ambigüedades. Los quistes tienen forma ovalada y miden típicamente 11-14 µm de largo y 6-10 µm de ancho. Otras características de los quistes de Giardia incluyen una pared bien definida (CW) que a menudo se separa del citoplasma del parásito. Los quistes pasan a las heces y pueden sobrevivir hasta tres meses en condiciones adecuadas de temperatura y humedad. Los quistes maduros son infecciosos para el próximo huésped que los ingiere, completando así el ciclo de vida.
El disco adhesivo
Una característica ultraestructural única de Giardia es el disco adhesivo (también llamado disco ventral, disco de succión, ventosa o disco estriado). El disco adhesivo es una estructura cóncava que ocupa aproximadamente dos tercios del extremo anterior de la superficie ventral (Figura, panel izquierdo). Como lo indican los nombres, esta estructura desempeña un papel en la unión del trofozoíto al epitelio intestinal y los estudios ultraestructurales revelan asociaciones cercanas entre el disco adhesivo y el borde del cepillo intestinal (Figura, panel superior derecho). (Haz clic aquí para ampliar la imagen.)
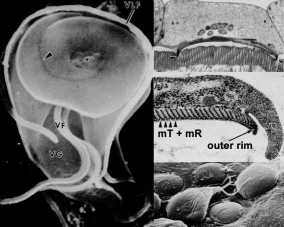 El disco adhesivo parece ser una estructura relativamente rígida y las estrías son evidentes por microscopía electrónica de transmisión. Estas estrías son el resultado de microtúbulos (mT) y un elemento citoesquelético único llamado microribbons (mR). Los microcintas son estructuras aplanadas largas y cada microribón está asociado con un microtúbulo (Figura, panel central derecho). La estructura combinada de microtúbulos-microrribón está dispuesta en filas concéntricas que forman una espiral aplanada con un mínimo solapamiento. El borde externo del disco adhesivo, llamado cresta lateral, contiene componentes del citoesqueleto de actina-miosina.
El disco adhesivo parece ser una estructura relativamente rígida y las estrías son evidentes por microscopía electrónica de transmisión. Estas estrías son el resultado de microtúbulos (mT) y un elemento citoesquelético único llamado microribbons (mR). Los microcintas son estructuras aplanadas largas y cada microribón está asociado con un microtúbulo (Figura, panel central derecho). La estructura combinada de microtúbulos-microrribón está dispuesta en filas concéntricas que forman una espiral aplanada con un mínimo solapamiento. El borde externo del disco adhesivo, llamado cresta lateral, contiene componentes del citoesqueleto de actina-miosina.
Un componente importante de los microribbons son proteínas llamadas giardins (también conocidas como beta-giardins). Estos giardins juegan principalmente un papel estructural en la formación de los microribbons. Curiosamente, los giardins muestran una homología limitada con una proteína llamada ‘ensamblaje de fibra estriada’ de Chlamydomonas (una alga unicelular bi-flagelada de vida libre). En Chlamydomonas esta proteína forma estructuras filamentosas en la base de los flagelos. Los giardins han evolucionado para desempeñar un papel funcional diferente en Giardia, pero aún están asociados con elementos citoesqueléticos basados en microtúbulos.
Esta asociación de proteínas involucradas en la generación de fuerza contráctil y otros elementos citoesqueléticos en el disco adhesivo sugiere que la unión está mediada por fuerzas mecánicas generadas por el parásito. La observación de que las huellas y las lesiones circulares en forma de cúpula permanecen en el borde del cepillo intestinal (es decir, microvilli) después del desprendimiento de trofozoitos (Figura, panel inferior derecho) es consistente con las fuerzas
contráctiles que juegan un papel en el acoplamiento. Otros mecanismos propuestos para la unión de Giardia al epitelio intestinal incluyen las fuerzas hidrodinámicas generadas por los flagelos ventrales y la unión mediada por receptores a través de lectinas sobre la superficie del trofozoíto. Sin embargo, el movimiento flagelar está mal correlacionado con la unión y las lectinas de la superficie cubren todo el trofozoíto y no se localizan específicamente en el disco adhesivo.
SINTOMAS Y PATOGENESIS
Las características clínicas asociadas con la infección por Giardia van desde la latencia total (es decir, asintomática), hasta la diarrea aguda de autodeterminación, hasta los síndromes crónicos asociados con trastornos nutricionales, pérdida de peso y retraso del crecimiento. Los niños presentan síntomas clínicos con mayor frecuencia que los adultos y las infecciones posteriores tienden a ser menos graves que las infecciones iniciales. El período de incubación es generalmente de 1 a 2 semanas, pero se han informado intervalos de 1 a 75 días.
Los primeros signos de giardiasis aguda incluyen náuseas, pérdida de apetito y un malestar gastrointestinal superior. Estos signos a menudo son seguidos o acompañados por una repentina aparición de diarrea acuosa, con olor desagradable. Las heces asociadas con la infección por Giardia generalmente se describen como flojas, voluminosas, espumosas y / o grasosas con ausencia de sangre o moco, lo que puede ayudar a distinguir la giardiasis de otras diarreas agudas. Otros trastornos gastrointestinales asociados con la giardiasis incluyen: flatulencia, distensión abdominal, anorexia, calambres y eructos sulfúricos asquerosos (a veces llamados “burbujas de color púrpura”). La etapa aguda generalmente se resuelve espontáneamente en 3 a 4 días y, a menudo, no se reconoce como giardiasis. De vez en cuando, sin embargo, una infección aguda persistirá y dará lugar a una mala absorción, esteatorrea (pérdida excesiva de grasa en las heces), debilidad (pérdida de fuerza) y pérdida de peso. Algunos de los individuos que resuelven los síntomas agudos no eliminan la infección, sino que se convierten en personas quistes asintomáticas sin manifestaciones clínicas, mientras que otros pueden tener algunas recurrencias esporádicas de los síntomas agudos.
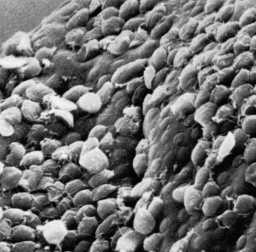 Las infecciones agudas también pueden convertirse en infecciones subagudas o crónicas de larga duración que en casos raros duran años. El paciente en etapa crónica típica presenta episodios breves recurrentes de heces fecales sueltas que pueden ser amarillentas, espumosas y flotantes, acompañadas de gorgoteo intestinal, distensión abdominal y flatulencia. Entre los episodios, las heces suelen ser blandas, pero también pueden ocurrir heces normales o estreñimiento. Los calambres son poco frecuentes durante las infecciones crónicas, pero los eructos sulfúricos son frecuentes. La anorexia, las náuseas y el malestar epigástrico son afecciones adicionales adicionales durante las infecciones crónicas. En la mayoría de los casos crónicos los parásitos y síntomas desaparecen espontáneamente.
Las infecciones agudas también pueden convertirse en infecciones subagudas o crónicas de larga duración que en casos raros duran años. El paciente en etapa crónica típica presenta episodios breves recurrentes de heces fecales sueltas que pueden ser amarillentas, espumosas y flotantes, acompañadas de gorgoteo intestinal, distensión abdominal y flatulencia. Entre los episodios, las heces suelen ser blandas, pero también pueden ocurrir heces normales o estreñimiento. Los calambres son poco frecuentes durante las infecciones crónicas, pero los eructos sulfúricos son frecuentes. La anorexia, las náuseas y el malestar epigástrico son afecciones adicionales adicionales durante las infecciones crónicas. En la mayoría de los casos crónicos los parásitos y síntomas desaparecen espontáneamente.
Los mecanismos específicos de la patogénesis de Giardia que conducen a la diarrea y la malabsorción intestinal no se conocen completamente y no se han identificado factores de virulencia específicos. La fijación de trofozoitos al borde del cepillo podría producir una irritación mecánica o lesión de la mucosa. Además, la estructura de las vellosidades normales se ve afectada en algunos pacientes. Por ejemplo, se ha observado en varios grados un embellecimiento de las vellosidades (atrofia) y una hipertrofia de las células de la cripta y un aumento en la profundidad de la cripta. El aumento en las células de la cripta conducirá a una repoblación del epitelio intestinal por enterocitos relativamente inmaduros con capacidades de absorción reducidas. También se ha observado un aumento de la infiltración de células inflamatorias en la lámina propia y esta inflamación puede estar asociada con la patología. La infección por Giardia también puede conducir a una deficiencia de lactasa (ver intolerancia a la lactosa a continuación), así como a otras deficiencias de enzimas en las microvillas. Esta reducción de la digestión y la absorción de los solutos puede conducir a una diarrea osmótica y también podría explicar los síndromes de malabsorción. Hasta ahora, ningún factor de virulencia o mecanismo de unificación explica la patogenia de la giardiasis. [Vea también Fisiopatología de la diarrea para una discusión general sobre la diarrea.]
Post-Giardia intolerancia a la lactosa. Algunos pacientes pueden presentar intolerancia a la lactosa durante las infecciones activas de Giardia que pueden persistir después de la eliminación del parásito. Esta manifestación clínica se debe a la deficiencia de lactasa inducida por parásitos y es más común en grupos étnicos con una predisposición a la deficiencia de lactasa. La lactasa es una enzima que descompone la lactosa, un azúcar que se encuentra en la leche, en monosacáridos que pueden ser absorbidos. Este síndrome de intolerancia a la lactosa debe considerarse en personas que todavía presentan heces blandas y gases excesivos después del tratamiento, pero que no tienen parásitos detectables.
DIAGNÓSTICO
El diagnóstico se confirma al encontrar quistes o trofozoitos en las heces o en aspirados o biopsias duodenoyeyunales. La detección de los parásitos puede ser difícil ya que Giardia no aparece constantemente en las heces de todos los pacientes. Algunos pacientes expresan altos niveles de quistes en casi todas las deposiciones, mientras que otros solo exhiben bajos conteos de parásitos en algunas de las deposiciones. También se ha observado un patrón mixto, en el que se alternan períodos de alta excreción de quistes con períodos de baja excreción. Además, los parásitos son más fáciles de encontrar durante las infecciones agudas que las infecciones crónicas. La aspiración y la biopsia también pueden no confirmar la infección debida a loci de infección en parches, y algunos cuestionan la utilidad de estos procedimientos invasivos.
El examen de heces es el método preferido para el diagnóstico de Giardia. Se deben examinar tres deposiciones tomadas a intervalos de al menos dos días. Las heces acuosas o sueltas pueden contener trofozoitos móviles que son detectables por el examen inmediato de frotis húmedos. De lo contrario, la muestra debe conservarse y teñirse debido a la labilidad del trofozoíto. Los quistes más fuertes son relativamente fáciles de reconocer, ya sea en frotis directos o teñidos (ver morfología del quiste). Además, también están disponibles kits de diagnóstico basados en inmunofluorescencia o la detección de coproantígenos.
El diagnóstico también se puede hacer al examinar el líquido duodenal en busca de trofozoitos. El líquido duodenal se obtiene por intubación o Enterotest® (también llamado “test de cuerdas”). El Enterotest® consiste en una cápsula de gelatina que contiene una cuerda de nylon de la longitud adecuada. El extremo libre de la cuerda se sujeta con cinta adhesiva a la cara del paciente y se traga la cápsula. Después de cuatro horas hasta la noche, la cuerda se recupera y el moco teñido con bilis en la parte distal de la cuerda se raspa y se examina con un montaje húmedo y una tinción permanente. Una pequeña biopsia intestinal, preferiblemente de múltiples sitios duodenales y yeyunales, también
puede revelar trofozoitos unidos al epitelio intestinal. [El intestino delgado se divide en 3 secciones: el duodeno (primera porción o porción proximal después del estómago); el yeyuno (la porción media); y el íleon (la porción distal o última antes del intestino grueso).]
TRATAMIENTO Y CONTROL
Las personas infectadas deben recibir tratamiento, ya que Giardia puede persistir y llevar a síndromes de malabsorción severa y pérdida de peso. El tratamiento es eficaz para reducir la morbilidad y no hay secuelas. El metronidazol (Flagyl®), aunque no tiene licencia en los Estados Unidos para la giardiasis, elimina efectivamente el parásito (tasas de curación de aproximadamente el 85%) y es el fármaco de elección. La dosis recomendada es de 750 mg tres veces al día durante cinco días (o al menos> 3 días). Para niños se recomienda 15 mg / kg / d en tres dosis. Otros medicamentos efectivos incluyen: quinacrina (Atabrine®), tinidazol (Fasigyn®), furazolidona (Furoxone®) y paramomicina (Humatin®). Tinidazol es eficaz como una dosis única de dos gramos; La paramomicina no se absorbe y puede ser útil durante el embarazo.
La distribución generalizada de Giardia y la infectividad de los quistes hacen que sea poco probable que la infección humana se elimine por completo. Las medidas de control para prevenir o reducir la infección por Giardia dependerán de las circunstancias específicas de la transmisión, pero en general implican medidas que evitan la ingestión de sustancias contaminadas con material fecal (consulte Factores de transmisión fecal-oral). La promoción de la salud y la educación dirigidas a mejorar la higiene personal, y hacer hincapié en el lavado de manos, el saneamiento y la manipulación de alimentos, son actividades de control efectivas para la reducción de la transmisión de persona a persona. Se necesita atención especial a la higiene personal en situaciones de alto riesgo, como guarderías y otras instituciones. El tratamiento de los miembros asintomáticos del hogar previene la reinfección en áreas no endémicas. Sin embargo, el valor de tratar portadores asintomáticos en comunidades hiperendémicas es cuestionable ya que las tasas de reinfección son altas. La situación socioeconómica en muchos países en desarrollo dificulta la prevención de infecciones. Se requieren medidas de salud pública para proteger los suministros de agua de la contaminación para prevenir epidemias y reducir la endemicidad. Los turistas no deben beber agua del grifo sin tratamiento adicional en lugares donde la pureza es cuestionable. El tratamiento con ebullición o con yodo mata los quistes de Giardia, pero la cloración estándar no. No existen medicamentos quimioprofilicos seguros o efectivos para la giardiasis.
Tricomonasis
- Tricomonad Morfología Y Especies
- Transmisión y Ciclo de Vida
- Síntomas y Patogenia
- Diagnóstico, Tratamiento y Control.
Las tricomonas son un grupo de protozoos flagelados. La mayoría de los miembros de este grupo son parásitos y solo se han identificado unas pocas especies de vida libre. En general, las tricomonas son comensales no patógenos y solo unas pocas especies son importantes en animales y humanos. Cuatro especies de tricomonas infectan a los humanos (Tabla). Entre estos, solo Trichomonas vaginalis es claramente patógeno y generalmente es de baja virulencia. Los otros exhiben una patogenicidad cuestionable.
| Trichomonads de Humanos | |
| Especies |
Ubicación
|
| tricomonas vaginalis | tracto uro-genital |
| Trichomonas tenax | cavidad oral |
| Pentatrichomonas hominis | intestino |
| Dientamoeba fragilis | intestino |
Las tricomonas de los humanos habitan en diferentes lugares anatómicos. T. vaginalis es una enfermedad común de transmisión sexual que se encuentra en el tracto uro-genital. T. tenax, también llamada T. buccalis, es un comensal de la cavidad oral humana, que se encuentra particularmente en pacientes con una higiene bucal deficiente y enfermedad periodontal avanzada. T. tenax, o un organismo con morfología similar también se encuentra ocasionalmente en los pulmones. Tales casos se han reportado principalmente en pacientes con cánceres subyacentes u otras enfermedades pulmonares o después de una cirugía. Pentatrichomonas hominis, anteriormente conocido como Trichomonas hominis, es un comensal no patógeno del intestino grueso (consulte los flagelados intestinales no patógenos). Algunos autores dividen las tricomonas en tres géneros según el número de flagelos libres. Las especies con tres flagelos se llaman Tritrichomonas, aquellas con cuatro se llaman Trichomonas, y Pentatrichomonas se refiere a trichomonadas con cinco flagelos anteriores libres. Dientamoeba fragilis originalmente se creía que era una ameba (ver ameba intestinal no patógena). Ahora se sabe que es un flagelado, aunque sin flagelos, relacionado con las tricomonas.
Una característica distintiva de las tricomonas es un axostilo (hacha) que recorre la longitud del organismo y parece sobresalir del extremo posterior (Figura). El axostilo es un elemento citoesquelético compuesto por filas concéntricas de microtúbulos y se cree que funciona en la unión del parásito a las células epiteliales. Las tricomonas también se caracterizan por 4-6 flagelos (fg) que emergen del extremo anterior. Uno de los flagelos está unido al cuerpo del organismo y forma una membrana ondulada dirigida hacia la parte posterior (um), mientras que los flagelos restantes están libres. Los cuerpos basales combinados (bb) y la base de la membrana ondulada, llamada costa (cs), se ven a menudo en preparaciones teñidas. Menos frecuente es el surco citostomal (cy). Se encuentra un solo núcleo (nu) en el extremo anterior del parásito.
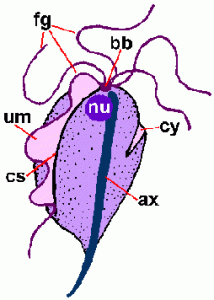
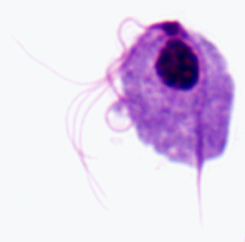
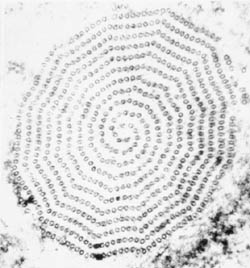
Representación esquemática de las principales características estructurales de las tricmonadas (izquierda). Trofozoito teñido con Giemsa de T. vaginalis de cultivo in vitro (medio). Micrografía electrónica de la sección transversal del axostilo que muestra filas concéntricas de microtúbulos (derecha).
Las tricomonas, como muchos otros protozoos intestinales, exhiben un metabolismo aneróbico y carecen de mitocondrias. Parte del metabolismo energético de las tricomonas implica un orgánulo único llamado hidrogenosoma. El hidrogenosoma tiene una doble membrana y está relacionado de forma distante con la mitocondria. Sin embargo, carece de ADN, citocromos y muchas funciones mitocnondriales típicas, como las enzimas del ciclo del ácido tricarboxílico y la fosforilación oxidativa. La función principal del hidrogenosoma es el metabolismo del piruvato, producido durante la glucólisis dentro del citosol, al acetato y al dióxido de carbono con la producción concomitante de ATP. Los electrones que se liberan de la oxidación del piruvato se transfieren a los iones de hidrógeno para producir hidrógeno molecular, de ahí el nombre de hidrogenosoma.
TRICHOMONAS VAGINALIS
Trichomonas vaginalis was first described from purulent vaginal discharges in 1836 and by the early part of the twentieth century was recognized as an etiological agent of vaginitis. Trichomoniasis is a common sexually transmitted disease with a worldwide distribution and an estimated 167 million people becoming infected per year worldwide and 5 million new infections per year in the United States. Trichomoniasis is believed to be the most common non-viral sexually transmitted disease. Despite the frequency of trichomoniasis it has in the past been considered more of a nuisance parasite rather than a major pathogen. However it is now recognized a factor in promoting HIV infection (see Box), causing low-weight and premature births, and predisposing women to substantial discomfort and stress.
|
Trichomonas y VIH |
|
La patología causada por Trichomonas puede mejorar la eficacia de la transmisión del VIH (1). La infección por T. vaginalis típicamente provoca una respuesta inmune celular local con inflamación del epitelio vaginal y el cuello uterino en las mujeres y la uretra de los hombres. Esta respuesta inflamatoria incluye la infiltración de posibles células diana del VIH, como los linfocitos y macrófagos que contienen CD4 +. Además, T. vaginalis puede causar hemorragias puntiformes en las paredes vaginales y el cuello uterino. Esta infiltración de leucocitos y las lesiones genitales pueden aumentar el número de células diana para el virus y permitir el acceso viral directo al torrente sanguíneo a través de lesiones abiertas. Además, las hemorragias y la inflamación pueden aumentar el nivel de virus en los fluidos corporales y el número de linfocitos y macrófagos infectados por el VIH presentes en el área genital en personas que ya están infectadas con el VIH. Este aumento de virus libres y leucocitos infectados por virus puede aumentar la probabilidad de exposición y transmisión del VIH a una pareja no infectada. Se ha demostrado que el aumento de la diseminación cervical del VIH está asociado con la inflamación cervical, y se ha documentado un aumento sustancial de las cargas virales en el semen en hombres con tricomoniasis. Además, dado que muchos pacientes con infección por Trichomonas son asintomáticos, o solo levemente sintomáticos, es probable que permanezcan sexualmente activos a pesar de la infección. Sorvillo F, Smith L, Kerndt P, Ash L. (2001) Trichomonas vaginalis, VIH y afroamericanos. Emerg Infect Dis. 7: 927-32. |
T.vaginalis, a pesar de su nombre, infecta tanto a hombres como a mujeres. En las mujeres, el organismo habita principalmente la vagina, y en los hombres generalmente se encuentra en la uretra, la próstata o el epidídimo. El ciclo de vida consiste solo en una etapa de trofozoito que se transmite por contacto directo durante las relaciones sexuales. La transmisión no venérea es rara, pero es posible ya que los trofozoitos pueden sobrevivir entre 1 y 2 días en la orina y entre 2 y 3 horas con una esponja húmeda. Además, se han infectado neonatales durante el proceso de nacimiento. Los trofozoitos viven estrechamente asociados o unidos al epitelio del tracto urogenital, donde se replican por fisión binaria.
SINTOMAS Y PATOGENESIS
|
Manifestaciones clínicas |
|
| Hembras | Los machos |
| asintomático (15-20% *) | asintomático (50-90% *) |
| secreción vaginal (50-75% *) | secreción uretral (50-60% **) |
| dispareunia (50% *) | disuria (12-25% **) |
| prurito (25-50% *) | Prurito uretral (25% **) |
| *% de infectados; **% de sintomático | |
T.vaginalis causa diferentes manifestaciones clínicas en hombres y mujeres y las mujeres (Tabla) tienen más probabilidades de presentar síntomas que tienden a persistir por más tiempo. El período de incubación típicamente varía de 4 a 28 días. En las mujeres, la infección puede presentarse como una vaginitis leve, una vulvovaginitis aguda o crónica, o uretritis. El inicio o la exacerbación de los síntomas comúnmente ocurre durante o inmediatamente después de la menstración. La queja más
común asociada con la infección por T. vaginalis es una vaginitis leve persistente asociada con una descarga copiosa y de mal olor que a menudo se acompaña de ardor o picazón. Esta descarga suele ser gris, pero puede ser amarilla o verde y ocasionalmente es espumosa o teñida de sangre. La descarga disminuye a medida que la infección se vuelve más crónica. Muchas mujeres también experimentan coito doloroso o difícil. La afectación uretral ocurre en una gran cantidad de casos y se caracteriza por disuria (micción dolorosa) y micción frecuente.
El epitelio vaginal es el sitio primario de la infección. Por lo tanto, las paredes vaginales suelen ser eritematosas (es decir, rojas) y pueden mostrar hemorragias petequiales (una pequeña mancha no elevada). En aproximadamente el 2% de los casos se observan hemorragias puntiformes del cérvix, llamadas cérvix de fresa. Este cérvix de fresa es una observación patológica distintiva asociada a la tricomonasis no vista con otras enfermedades de transmisión sexual.
Es probable que los varones sean asintomáticos (50-90%) y la infección tiende a autolimitarse. La uretra y la próstata son los sitios más comunes de infección. Los síntomas comunes incluyen: secreción uretral (que va de escasa a purulenta), disuria y prurito uretral (picazón). Algunos hombres experimentan ardor inmediatamente después del coito.
Poco se sabe sobre la fisiopatología asociada con la infección por T. vaginalis, pero se debe probablemente a las interacciones entre el parásito y las células epiteliales del huésped. Los estudios in vitro indican que T. vaginalis puede destruir células de manera dependiente del contacto. Por lo tanto, se cree que la adhesión de los trofozoitos al epitelio es un factor importante en la patogénesis. Se han identificado varias proteínas de adhesión en la superficie de los trofozoitos. Además, también se han identificado proteasas secretadas que podrían desempeñar un papel en la patogénesis.
DIAGNÓSTICO, TRATAMIENTO Y CONTROL
En general, las manifestaciones clínicas no son confiables como únicos medios de diagnóstico, ya que la presentación clínica es similar a otras ETS y muchos pacientes tienen síntomas leves o no presentan síntomas. El diagnóstico se confirma mediante la demostración de trofozoitos en secreciones vaginales, uretrales, prostáticas o de orina (después de un masaje de próstata). El método de diagnóstico más práctico es el examen microscópico de monturas húmedas de secreción vaginal fresca, preferiblemente recolectadas con un espéculo en un aplicador con punta de algodón. Las muestras deben diluirse en solución salina y examinarse inmediatamente. T. vaginalis es reconocido por sus características morfológicas características (ver arriba) y su rápida motilidad espasmódica. Las muestras también se pueden fijar y teñir con Giemsa o tintes fluorescentes. Sin embargo, el organismo puede ser difícil de reconocer en los portaobjetos teñidos.
La sensibilidad de la observación directa oscila entre el 40-80%. Por lo tanto, el cultivo in vitro se considera el estándar de oro para el diagnóstico a pesar de algunas limitaciones. Por ejemplo, se necesita acceso a las instalaciones y los organismos requieren de 2 a 7 días de crecimiento antes de ser detectados. El problema de accesibilidad se resuelve en parte con el sistema de cultivo de TV InPouch ™ (Biomed Diagnostics). Este es un sistema autónomo disponible comercialmente para la detección de T. vaginalis en muestras clínicas. Se están desarrollando pruebas basadas en anticuerpos y ADN con alta sensibilidad y especificidad.
El metronidazol (Flagyl®) y otros nitroimidazoles, como el tinidazol, son altamente efectivos contra la tricomoniasis. El metronidazol es activado por el hidrogensoma a un intermedio nitro radical iónico. Se puede usar una dosis única de dos gramos (85-92% de curación) o 250 mg tres veces al día durante 7-10 días (> 95% de curación). Las parejas sexuales deben ser tratadas al mismo tiempo para prevenir la reinfección. Se ha informado algo de resistencia a los medicamentos, pero esto no es un problema generalizado. Los fracasos de tratamiento generalmente se deben a un incumplimiento o reinfección.
La epidemiología de la tricomonasis muestra características similares a otras enfermedades de transmisión sexual (recuadro) y la incidencia se correlaciona con el número de parejas sexuales.
Además, la coinfección con otras ETS es común. Se estima que hasta el 25% de las mujeres sexualmente activas se infectarán en algún momento de sus vidas y la enfermedad se transmitirá al 30-70% de sus parejas masculinas. Las medidas utilizadas en el control de otras enfermedades de transmisión sexual, como la limitación del número de parejas sexuales y el uso de condones, también son efectivas para prevenir la tricomoniasis.
|
Tricomoniasis como una ETS |
|
Comentarios sobre la tricomoniasis:
Lehker, M.W. y Alderete, J.F. (2000) Biology of trichomonosis. Opinión actual en enfermedades infecciosas 13, 37-45.
Petrin, D., Delgaty, K., Bhatt, R., Garber, G. (1998) Aspectos clínicos y microbiológicos de Trichomonas vaginalis. Clinica Microbiol. Ap. 11: 300-317.
Schwebke, J.R. y Burgess, D. (2004) Trichomoniasis. Revisiones de Microbiología Clínica 17, 794-803.
DIENTAMOEBA FRAGILIS
Dientamoeba fragilis se describió originalmente como una ameba basada en su morfología. Sin embargo, más tarde se reconoció que presentaba una morfología más similar al parásito del pavo Histomonas meleagridis, excepto por la falta de flagelos. Los estudios ultraestructurales también sugieren similitudes con las tricomonas, incluyendo la posesión de hidrogenosomas y los estudios moleculares han confirmado una estrecha relación filogenética entre Dientamoeba e Histomonas y una posible relación más distal con Trichomonas.
Al igual que con otras tricomonas, Dientamoeba solo exhibe una etapa de trofozoíto (Figura). Esto plantea algunas preguntas sobre el modo de transmisión en que una etapa de quiste suele estar involucrada en la transmisión oral fecal. Además, los trofozoitos de Dientamoeba sobreviven fuera del cuerpo por un tiempo muy corto. H. meleagridis también carece de una etapa de quiste y se ha demostrado que se transmite a través de los huevos de un nematodo. Debido a la estrecha relación entre Histomonas y Dientamoeba, se propone que Dientamoeba también se transmita a través de huevos de helmintos. La evidencia epidemiológica y experimental tiende a incriminar al gusano Enterobius vermicularis como portador de Dientamoeba. Más recientemente, se ha demostrado que los cerdos son un huésped natural para D. fragilis del mismo genotipo que se encuentra en los humanos, lo que aumenta la posibilidad de una transmisión zoonótica (Cacciò et al, Emerg Infect Dis 18 (5): 838–841 2012).
Históricamente, Dientamoeba ha sido considerada como un comensal no patógeno. Sin embargo, los síntomas clínicos a menudo se correlacionan con la presencia de grandes cantidades de trofozoitos y el tratamiento de la infección resuelve los síntomas. La incidencia de síntomas se estima en 15-30% de los individuos infectados. Los síntomas clínicos asociados con Dientamoeba incluyen diarrea
intermitente, dolor abdominal, flatulencia, náuseas y fatiga. Poco se sabe acerca de la patogenia y Dientamoeba probablemente actúa como un irritante de bajo grado de las superficies de la mucosa intestinal que puede conducir a cierta inflamación. Iodoquinol es generalmente el fármaco de elección para el tratamiento de Dientamoeba. La paromomicina y el metronidazol también son efectivos.
Reseñas de Dientamoeba
Johnson et al (2004) Emerging from dark: aspectos biológicos, clínicos y diagnósticos de Dientamoeba fragilis. Clin Microbiol Rev 17: 553.
Barratt JL et al (2011) Una revisión del transporte de Dientamoeba fragilis en humanos: varias razones por las que este organismo debe considerarse en el diagnóstico de enfermedades gastrointestinales. Microbios intestinales 2: 3–12.
BALANTIDOSIS
SEMBalantidium coli es el único ciliado que infecta a los humanos. Se encuentra en todo el mundo, pero como muchas otras enfermedades de transmisión fecal-oral, es más frecuente en los trópicos. Sin embargo, las tasas de prevalencia rara vez superan el 1%. B. coli también infecta una amplia variedad de mamíferos y es especialmente común en monos y cerdos. La prevalencia en cerdos varía de 20 a 100% y la balantidiosis humana generalmente muestra una mayor prevalencia en comunidades que viven en estrecha asociación con cerdos. Por ejemplo, en Papúa Nueva Guinea, donde los cerdos son los principales animales domésticos, se ha informado que la prevalencia entre los pastores porcinos y los trabajadores de los mataderos es tan alta como el 28%. La transmisión de persona a persona también se ha documentado y es probable que este modo de transmisión se produzca en entornos con mucha gente y poca higiene personal, como hospitales psiquiátricos y prisiones. (Saltar biología ciliada general)
BIOLOGIA GENERAL DEL CILIATO
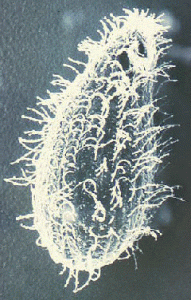
Los ciliados son un grupo grande y diverso de protozoos. La mayoría de los ciliados viven en libertad y se encuentran en una variedad de hábitats. Entre los ciliados más conocidos se incluyen especies de Paramecium, que se encuentran en estanques de todo el mundo, e Ichthyophthirius multifiliis, un ectoparásito de peces que causa la enfermedad de la mancha blanca (también llamada “ick”). Como su nombre lo indica, los ciliados poseen cilios en algún momento durante sus ciclos de vida. Los cilios generalmente están dispuestos en filas longitudinales y típicamente cubren la superficie del organismo. Los ciliados también se caracterizan por el dimorfismo nuclear porque tienen dos núcleos distintos. El gran macronúcleo con forma de riñón está involucrado en el “mantenimiento” o funciones somáticas de la célula, mientras que el micronúcleo esférico más pequeño contiene el genoma completo. El macronúcleo contiene miles de copias de ‘minicromosomas’ transcripcionalmente activos que representan 10-20,000 moléculas de ADN diferentes. Este gran número de telómeros (extremos cromosómicos) dio como resultado que los ciliados fueran un sistema modelo temprano para el estudio de los telómeros y la telomerasa (la enzima que sintetiza los telómeros).
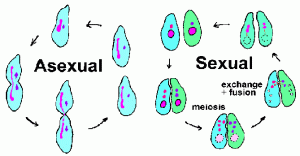
Los ciliados se someten tanto a una reproducción asexual (es decir, a una fisión binaria) como a una reproducción sexual que implica conjugación (Figura anterior). Durante la conjugación, dos ciliados de tipos de apareamiento opuestos se emparejan e intercambian material genético. El contacto conyugal desencadena la meiosis en los micronúcleos dando como resultado 4 micronúcleos haploides. Al mismo tiempo, el macronúcleo se descompone y desaparece. Tres de los micronúcleos se desintegran y el micronúcleo restante se divide nuevamente. Cada uno de los organismos conjugadores dona un micronúcleo (gamético o masculino) a su pareja a través de un puente citoplásmico que los conecta. El micronúcleo gamético se fusiona con el micronúcleo estacionario (o femenino) que forma el micronúcleo cigótico diploide. El par de conjuros se separa y los nuclueos cigóticos experimentan otra ronda de división. Uno de estos micronúcleos se desarrolla en el macronúcleo, completando así el ciclo. La formación del macronúcleo implica la fragmentación de los cromosomas y la pérdida de secuencias de ADN correspondientes a genes que no se expresan en niveles altos durante el ciclo asexual normal. Los fragmentos de ADN restantes, o minicromosomas, luego se amplifican. (Ver diagrama de procesamiento de ADN durante la formación de macronúcleos.)
BALANTIDOSIS
- coli generalmente vive como comensal no patógeno en el intestino grueso y no produce síntomas. Puede producirse una inflamación superficial de la mucosa colónica que puede causar diarrea y dolor cólico. Las infecciones leves o crónicas se caracterizan por diarrea intermitente y estreñimiento, pérdida de peso y dolor abdominal. En raras ocasiones los trofozoitos invaden el epitelio intestinal y producen ulceración. Clínicamente, esto resulta en una diarrea aguda con moco y sangre (es decir, disentería). Esta disentería balantidial es similar a la disentería producida por Entameoba histolytica (ver más abajo). Se han notificado infecciones extraintestinales poco frecuentes en los pulmones, la vagina, el uréter y la vejiga urinaria y las perforaciones intestinales que conducen a la peritonitis.
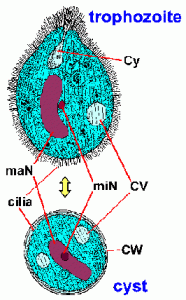
El diagnóstico de laboratorio se hace identificando el organismo en las heces. Balantidium exhibe un ciclo de vida fecal-oral típico que consiste en trofozoíto y quistes. El gran tamaño y las características morfológicas únicas de Balantidium (Figura) excluyen su confusión con cualquier otro protozoo
encontrado en las heces humanas. El trofozoíto es ovoide y tiene un tamaño promedio de 70 x 45 µm, pero puede variar hasta 150-200 µm. El quiste tiene una pared quística distintiva (CW) y es más esférico con un diámetro promedio de 55 µm. En muestras teñidas, la estructura interna más obvia es el macronúcleo grande (maN). El micronúcleo (miN) puede no ser siempre evidente debido a su estrecha asociación con el macronúcleo. Las vacuolas contráctiles (CV), que funcionan en la regulación osmótica, son a menudo visibles y, en ocasiones, el citostoma (Cy) es detectable. Al igual que muchos otros ciliados, Balantidium está cubierto por hileras de cilios. Los cilios le dan a la superficie del parásito un aspecto borroso y son menos pronunciados en la etapa del quiste.
El tratamiento de elección es la tetraciclina administrada a 500 mg cuatro veces al día durante 10 días. Iodoquinol es el medicamento alternativo recomendado. Metronidazol no ha producido resultados consistentes. Las medidas preventivas son las mismas que otras enfermedades transmitidas por vía fecal-oral (ver Factores de transmisión fecal-oral o discusión sobre la prevención de Giardia). Además, el alcantarillado porcino debe mantenerse alejado de los suministros de agua potable y alimentos.
Amebiasis
Varios miembros del género Entamoeba infectan a los humanos (ver más abajo). Entre estos, solo E. histolytica se considera patógeno y la enfermedad que causa se llama amebiasis o disentería amebiana. E. dispar es morfológicamente idéntico a E. histolytica y los dos se consideraron previamente como la misma especie. Sin embargo, los datos genéticos y bioquímicos indican que la E. histolytica no patógena es una especie distinta (ver discusión de criterios). Las dos especies se encuentran en todo el mundo, pero como muchos otros protozoos intestinales, son más comunes en países tropicales u otras áreas con malas condiciones sanitarias. Se estima que hasta un 10% de la población mundial puede estar infectada con E. histolytica o E. dispar y en muchos países tropicales la prevalencia puede acercarse al 50%. Se estima que hay 50 millones de casos de amebiasis por año y hasta 100,000 muertes.
- Ciclo de vida y morfología
- Patogenesia
- Posibles mecanismos de patogenia
- Figura esquemática de la invasión de trofozoitos
- Presentación clínica
- Diagnóstico, Tratamiento y Control.
Ciclo vital y morfología
histolytica exhibe un ciclo de vida fecal-oraltípico que consiste en quistes infecciosos pasados en las heces y trofozoitos que se replican dentro del intestino grueso. La infección se adquiere mediante la ingestión de quistes y los factores de riesgo son similares a otras enfermedades transmitidas por vía fecal-oral (ver Tabla). Los alimentos y el agua contaminados son probablemente las principales fuentes de infección. La mayor prevalencia en áreas de estatus socioeconómico más bajo es probable debido a la falta de saneamiento y la falta de tuberías interiores. Sin embargo, E. histolytica rara vez es la causa de la diarrea del viajero y generalmente se asocia con una estadía prolongada (> 1 mes) en un área endémica. También se observa una mayor prevalencia de infección por E. histolytica en instituciones, como hospitales psiquiátricos, orfanatos y prisiones, donde el hacinamiento y los problemas de contaminación fecal son factores que contribuyen. También se ha observado una alta prevalencia entre los homosexuales masculinos. Los humanos son el único huésped de E. histolytica y no hay reservorios de animales.
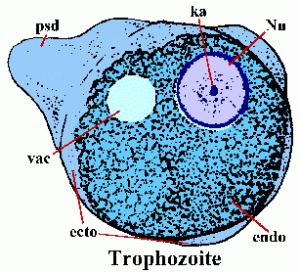
Tras la ingestión, los quistes pasan a través del estómago y se extraen de la parte inferior del intestino delgado. Excystation involucra una ruptura de la pared del quiste y la ameba cuadranucleada emerge a través de la abertura. La ameba se somete a otra ronda de división nuclear seguida de tres rondas sucesivas de citoquinesis (es decir, división celular) para producir ocho pequeños trofozoitos no introducidos, a veces llamados amebulas. Estos trofozoitos inmaduros colonizan el intestino grueso, especialmente las regiones cecal y sigmoidorectal, donde se alimentan de bacterias y desechos celulares y se someten arepetidas rondas de fisión binaria.
Los trofozoitos de E. histolytica tienen una forma amorfa y generalmente tienen un diámetro de 15-30 µm. Los trofozoitos se mueven extendiendo un pseudopodium (psd) similar a un dedo y tirando el resto del cuerpo hacia adelante (llamado movimiento ameboide). Los pseudopodios, y algunas veces el borde exterior del trofozoíto, tienen un aspecto refractario claro y se conocen como el ectoplasma (ecto). El resto del citoplasma tiene un aspecto granular y se llama endoplasma (endo). Ocasionalmente es evidente una vacuola de glucógeno (vac). La morfología nuclear (Nu) en muestras teñidas se caracteriza por un anillo finamente granular de cromatina periférica y un cariosoma central (ka).
Como alternativa a la replicación asexual, los trofozoitos también pueden enquistar. Los factores responsables de la inducción de la encistación son desconocidos. La quema comienza con los trofozoitos que se vuelven más esféricos y la aparición de cuerpos cromatoides en el citoplasma. Los cuerpos cromatoides (cb) son estructuras alargadas teñidas con extremos redondos y representan la agregación de ribosomas. La pared del quiste está compuesta de quitina y tiene un aspecto refráctil suave. La maduración del quiste involucra dos rondas de replicación nuclear sin división celular y se encuentran quistes con 1-4 núcleos (Nu) en las heces. La morfología nuclear del quiste es similar a la del trofozoíto, excepto que los núcleos se hacen cada vez más pequeños después de cada división. A veces, los quistes jóvenes (es decir, 1-2 núcleos) tendrán una vacuola de glucógeno (vac) que aparecerá como un área clara en las muestras teñidas. Esta vacuola a veces desplazará y alterará la morfología de los núcleos. Los cuerpos cromatoides tienden a desaparecer a medida que el quiste madura. Los quistes son generalmente de 12-15 µm de diámetro. Los quistes son inmediatamente infecciosos tras la excreción con las heces y serán viables durante semanas a meses, dependiendo de las condiciones ambientales.
PATOGENESIA
E .histolytica frecuentemente vive como comensal dentro del intestino grueso sin manifestaciones clínicas abiertas. Sin embargo, los trofozoitos pueden invadir el epitelio colónico y producir úlceras y disentería (véase el recuadro). Esta enfermedad invasiva puede empeorar progresivamente y llevar a una enfermedad más grave. Las amebas también pueden metastatizar a otros órganos y producir una amebiasis extraintestinal. En otras palabras, E. histolytica es un patógeno facultativo que exhibe un amplio rango de virulencia.
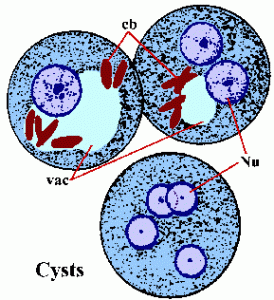
La enfermedad no invasiva a menudo es asintomática, pero puede causar diarrea u otros síntomas gastrointestinales, como dolor abdominal o calambres. Esta infección no invasiva puede persistir o progresar a una enfermedad invasiva en la que los trofozoitos penetran en la mucosa intestinal y matan las células epiteliales. La lesión temprana es un área pequeña de necrosis o úlcera, caracterizada por bordes elevados y prácticamente sin inflamación entre las lesiones (Figura). La ameba se extenderá lateralmente y hacia abajo en la submucosa (debajo del epitelio) y matará a las células huésped a medida que progresan. Esto resulta en la clásica úlcera ‘en forma de matraz’ con una pequeña abertura y una base ancha. Los trofozoitos son los más numerosos en el límite entre el tejido sano y el tejido necrótico. Estas amebas invasoras están ingiriendo células huésped y los trofozoitos con eritrocitos ingeridos a menudo son evidentes. Estos trofozoitos hematófagos a veces se encuentran en las heces disentéricas. La producción de quistes disminuye durante la etapa invasiva de la infección y nunca se encuentran quistes en las lesiones tisulares.
| Progresión de la amebiasis |
no invasivo
|
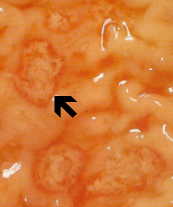
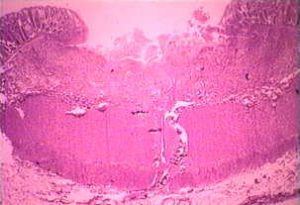
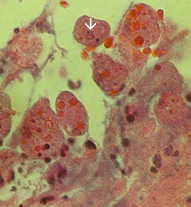
Izquierda: el lado lumenal del colon del caso de amebiasis fulminante que muestra varias úlceras. Tenga en cuenta los bordes levantados (flecha). Medio: preparación histológica que muestra una sección transversal de la úlcera. Tenga en cuenta el alto grado de necrosis en el centro de la úlcera. Las amebas avanzan lateralmente debajo de la mucosa intacta como lo indican las microvillas. Derecha: mayor aumento de la úlcera que muestra varios trofozoítos hematófagos. El núcleo (flecha) es evidente en una de las amebas. Imágenes de Peters y Gilles (1989), Un atlas de color de medicina tropical y parasitología (3ª edición).
El proceso ulcerativo puede continuar expandiéndose lateralmente o hacia abajo. Si hay un gran número de úlceras, pueden fusionarse, lo que podría provocar un desprendimiento localizado de la pared intestinal. La expansión de la úlcera también puede penetrar la capa serosa y provocar la perforación de la pared intestinal. Esta perforación puede provocar abscesos locales o una peritonitis generalizada. (Consulte también la representación esquemática de la invasión tisular). Las úlceras amebianas también pueden infectarse secundariamente con bacterias que pueden confundir el
cuadro clínico. Además, la infección por E. histolytica puede llevar ocasionalmente a la formación de un granuloma amebiano, también llamado ameboma. El ameboma es un engrosamiento inflamatorio de la pared intestinal alrededor de la úlcera que puede confundirse con un tumor.
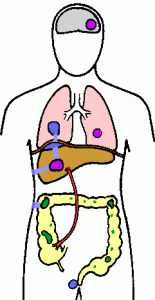
La amebiasis también puede progresar a una infección sistémica o extraintestinal. La diseminación de la lesión intestinal primaria es predominantemente a través del torrente sanguíneo, pero también puede ocurrir por extensión directa de la lesión. El hígado es el órgano más comúnmente afectado y esto se debe probablemente al transporte directo de trofozoitos desde el intestino grueso al hígado a través de la vena porta hepática (Figura). Inicialmente, las lesiones son pequeños focos de necrosis que tienden a unirse en un solo absceso a medida que se expanden. Este absceso hepático continuará agrandándose a medida que los trofozoitos destruyen e ingieren progresivamente las células huésped. El centro del absceso, que consiste en hepatocitos lisados, eritrocitos, bilis y grasa, puede licuarse y este material necrótico (a veces llamado incorrectamente pus) variará en color de amarillo a marrón rojizo. Las infecciones bacterianas secundarias en el absceso hepático no son comunes (~ 2%).
La propagación hematógena de los trofozoitos a otros sitios, como los pulmones o el cerebro, es rara, pero ocurre. El segundo sitio extraintestinal más común después del hígado son los pulmones. Las infecciones pulmonares generalmente resultan de una extensión directa de la lesión hepática a través del diafragma y en la pleura y los pulmones. Las lesiones cutáneas formadas como resultado de la fístula hepática o intestinal también pueden ocurrir, aunque son extremadamente raras. Otras lesiones cutáneas incluyen úlceras perianales y afectación de los genitales, incluido el pene de los homosexuales. Estas manifestaciones tardías se deben probablemente a que la piel o las membranas mucosas entran en contacto con trofozoitos invasivos.
POSIBLES MECANISMOS DE LA PATOGENIA
Como se discutió anteriormente, E. histolytica es un patógeno que exhibe un amplio espectro de virulencia, que va desde un organismo comensal avirulento hasta un organismo altamente invasivo y destructivo (ver discusión de patogenicidad contra virulencia). Parte de esta diferencia en la virulencia se explica por la existencia de la E. dispar morfológicamente idéntica, pero avirulenta. E. dispar nunca se ha asociado con una enfermedad invasiva sintomática y la infección no provoca anticuerpos séricos. En contraste, las respuestas humorales anti-ameba se observan tanto en las infecciones asintomáticas como en las sintomáticas de E. histolytica. Esto sugiere que incluso en casos asintomáticos hay una cantidad limitada de invasión. Sin embargo, la infección con E. histolytica no siempre conduce a una enfermedad invasiva, ya que solo alrededor del 10% de los individuos infectados desarrollarán amebiasis sintomática invasiva. Los factores responsables de la patogenia de E. histolytica no se conocen bien. Un enfoque para comprender la patogenia es comparar los posibles factores de virulencia entre estas dos especies estrechamente relacionadas.
|
Prevalencias Entamoeba |
Se observaron bolsas endémicas discretas de E. histolytica. ~ 25% de seropositivos para E. histolytica en áreas endémicas ~ 10% infectado con E. histolytica desarrollará amebiasis invasiva |
Los resultados patológicos de las interacciones huésped-parásito y, por lo tanto, los factores del huésped, los factores del parásito o una combinación de ambos pueden contribuir al estado de la enfermedad. Por ejemplo, el desarrollo de una enfermedad invasiva podría deberse a aspectos cuantitativos o cualitativos de la respuesta inmune del huésped. El reclutamiento de neutrófilos y la inflamación intensa se observan en las fases iniciales de la invasión amebiana. Sin embargo, la inflamación que rodea las úlceras y los abscesos establecidos es a menudo mínima, dado el grado de daño tisular.
La naturaleza de las respuestas inmunitarias protectoras no está clara. La inmunidad innata o inespecífica, así como la inmunidad adquirida, son probablemente importantes para la prevención de enfermedades invasivas. La capa mucosa que cubre las células epiteliales puede prevenir el contacto entre el trofozoíto y las células huésped. Además, las respuestas de IgA en la mucosa ocurren como resultado de la infección y la IgA fecal contra una lectina de superficie de trofozoíto (ver Eh-lectina) se asocia con una menor incidencia de nuevas infecciones por E. histolytica. Altos títulos de anticuerpos séricos también se desarrollan en pacientes con abscesos hepáticos. Sin embargo, dado que la enfermedad invasiva es a menudo progresiva y constante, se cuestiona el papel de estos anticuerpos anti-ameba. Las respuestas mediadas por células parecen desempeñar un papel en la limitación de la extensión de la amebiasis invasiva y en la protección del huésped contra la recurrencia después de un tratamiento exitoso.
| Posibles factores de virulencia |
factores del huésped
factores parásitos
|
La resistencia a la respuesta inmune del huésped es otro posible factor de virulencia que podría contribuir al desarrollo y exacerbación de la enfermedad invasiva. Por ejemplo, una diferencia fenotípica entre E. dispar y E. histolytica es la resistencia de este último a complementar la lisis mediada (ver E. dispar). Además, E. histolytica degrada rápidamente la IgA secretora y posiblemente suprime las respuestas de las células T a los antígenos de E. histolytica. E. histolytica también puede matar células, incluidos los neutrófilos y otras células efectoras inmunes, de una manera dependiente del contacto. La lisis de los neutrófilos también podría liberar productos tóxicos que contribuyen a la destrucción del tejido del huésped. Sin embargo, el papel de estos diversos fenómenos en la patogénesis no se conoce.
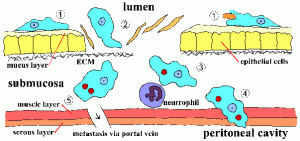
La invasión de la mucosa intestinal por E. histolytica es un proceso activo mediado por el parásito y se pueden reconocer distintos pasos (Figura, haga clic aquí para obtener una imagen más grande y una leyenda detallada). Los trofozoitos se adhieren a la capa de moco (paso 1). Esta adherencia per se probablemente no contribuye a la patogénesis y es simplemente un mecanismo para que la ameba se arrastre a lo largo del sustrato. El agotamiento de la barrera mucosa permite que el trofozoito entre en contacto con las células epiteliales. Las células epiteliales se destruyen de una manera dependiente del contacto que conduce a una ruptura de la mucosa intestinal (paso 2). Los trofozoitos continuarán matando las células huésped en la submucosa y alterarán aún más el tejido a medida que avanzan (paso 3). La interrupción de la pared intestinal (paso 4) o la metástasis a través del sistema circulatorio (paso 5) también es posible. La adherencia, la citotoxicidad y la alteración de los tejidos son factores importantes en la patogénesis de E. histolytica. Las proteínas parásitas que podrían desempeñar un papel en estos procesos incluyen: la Eh-lectina, Amebapore y las proteasas.
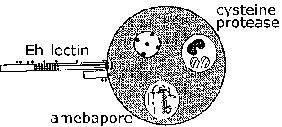
Eh-lectina. E. histolytica puede matar células a los pocos minutos de adherirse a ellas en presencia de calcio extracelular. La adherencia de los trofozoitos de E. histolytica a las células huésped y las mucinas colónicas está mediada por una actividad de lectina expresada en la superficie de la ameba. Esta lectina se une a galactosa o N-acetil-D-galactosamina (GalNAc) con una alta afinidad y también se denomina proteína de adherencia inhibible por galactosa (GIAP) o la lectina Gal / GalNAc. La destrucción de las células diana dependiente del contacto es casi completamente inhibida por la galactosa o GalNAc y las células diana que carecen de residuos de galactosa terminales en su superficie, las glicoproteínas son resistentes a la adherencia del trofozoíto y la citotoxicidad. Esto sugiere que la lectina Gal / GalNAc es un importante factor de virulencia. Además, la Eh-lectina está involucrada en la resistencia para complementar la lisis mediada. Debido a su papel potencial en la adherencia y la virulencia y debido a que la IgA fecal protege contra la colitis amebiana, Gal / GalNAc es una vacuna candidata (Petri et al, 2006, Arch. Med. Res. 37: 288).
La Eh-lectina es un heterodímero que consiste en una cadena pesada de 170 kDa y una cadena ligera de 31-35 kDa unidas por enlaces disulfuro. Una subunidad intermedia de 150 kDa no está asociada de manera covalente con el heterodímero. La cadena pesada tiene un dominio transmembrana y un dominio de unión a carbohidratos. Todas las subunidades están codificadas por familias multigénicas. Hay cinco miembros de la familia de la cadena pesada, 6-7 miembros de la familia de la cadena ligera y 30 miembros de la familia de la cadena intermedia. Los miembros de la familia de genes de la cadena pesada exhiben un 89-95% de identidad de secuencia a nivel de aminoácidos, mientras que los miembros de la familia de cadenas ligeras están menos conservados compartiendo solo el 79-85% de identidad de secuencia.
dispar también expresa la lectina Gal / GalNAc en su superficie. Tanto E. dispar como E. histolytica deben adherirse a la capa mucosa que es medicada por la lectina Gal / GalNAc. El moco se compone de glicoproteínas llamadas mucinas. La mucina predominante que se encuentra en la mucosa intestinal es Muc2, que está muy glicosilada con residuos de GalNAc unidos a O. La secuencia de los genes de la cadena ligera y pesada de E. dispar son homólogos, pero no idénticos, a los de E. histolytica. Las diferencias antigénicas entre el GIAP de E. dispar y E. histolytica también se han descrito en que solo dos epítopes de cada seis se comparten entre las dos especies (ver E. dispar). No se sabe si estas diferencias de secuencia pueden explicar las diferencias en la virulencia entre E. dispar y E. histolytica. La adherencia es obviamente importante para ambas especies, pero es posible que la adherencia sea cualitativa o cuantitativamente diferente entre las dos especies.
[Revisión sobre la Eh-lectina: Petri et al (2002) Annu. Rev. Microbiol. 56:39.]
Amebapore. Se ha identificado una familia de polipéptidos formadores de poros en E. histolytica y E. dispar. Los tres miembros de la familia se designan como amebapore A, B y C, siendo amebapore A la expresión predominante. El polipéptido maduro tiene una longitud de 77 aminoácidos y forma dímeros a pH bajo (4-6). Tres de estos dímeros luego se ensamblan en una estructura en forma de anillo hueco. Este hexámero puede entonces intercalarse en las membranas e introducir poros de 2 nm (es decir, agujeros) que dan como resultado la muerte celular. La actividad de formación de poros depende de este proceso de ensamblaje que comienza con la dimerización. Amebabpore A es idéntico en un 95% (es decir, cuatro residuos son diferentes) entre E. histolytica y E. dispar. Además, la E. dispar amebapore tiene aproximadamente la mitad de la actividad de formación de poros que la E. histolytica amebapore. Esta diferencia en la actividad de formación de poros se ha atribuido a un residuo de glutamato en la posición 2 en la E. histolytica amebapore, en comparación con un residuo de prolina en la E. dispar amebapore. Este residuo de aminoácido particular es importante para la formación de los dímeros y se cree que los dímeros de E. dispar amebapore son menos estables.
Amebapore se localiza en los compartimentos de vacío (por ejemplo, vacuolas de alimentos) dentro del trofozoíto y es más activo a pH ácido, lo que sugiere que la función principal de amebapore es lisar las bacterias ingeridas. No obstante, amebapore está implicado como un factor de virulencia en la manipulación genética de E. histolytica que resulta en una disminución de la expresión de amebapore que conduce a una reducción en la patogenicidad (capacidad de formar abscesos hepáticos), así como a una reducción en la actividad bactericida (Bracha et al Mol. Microbiol. 34: 363, 1999). De manera similar, E. histolytica modificada completamente sin producción de amebapore no puede formar abscesos hepáticos en sistemas modelo (Zhang et al, Inf. Imm. 72: 678, 2004). Sin embargo, estas amebas pueden causar inflamación y daño tisular en modelos para la colitis amebiana.
[Comentario sobre amebapore: Leippe et al, Tr. Parasitol. 21: 5, 2005.]
Proteasas Las proteasas son enzimas que degradan otras proteínas y podrían contribuir a la patogénesis causada por E. histolytica. En este sentido, E. histolytica expresa y secreta niveles más altos de cisteína proteasas, una clase particular de proteasa, que E. dispar. Se ha demostrado que las proteasas de cisteína interrumpen la polimerización de MUC2, el componente principal del moco colónico. Este moco degradado es menos eficaz para bloquear la adherencia de los trofozoitos a las células epiteliales. La destrucción de la matriz extracelular (ECM) por las proteasas también puede facilitar la invasión del trofozoíto. Los inhibidores de la cisteína proteasas pueden disminuir el tamaño del absceso hepático en modelos experimentales.
Se han identificado veinte genes de cisteína proteasa diferentes en E. histolytica. Los ortólogos de dos de los genes de la cisteína proteasa de E. histolytica no se encuentran en E. dispar. Uno de estos, denominado CP5, se expresa en niveles altos en la superficie del trofozoíto. Los mutantes que expresaban niveles más bajos de CP5 tenían una capacidad reducida para generar abscesos hepáticos en un modelo de amebiasis de hámster. Sin embargo, estos mutantes también tenían una tasa de crecimiento reducida y una menor actividad eritrofagocítica, por lo que no está claro si el CP5 participa directamente en la invasividad de E. histolytica. Además, la inhibición del 90% de la actividad de CP5 no afectó la capacidad de los trofozoitos de E. histolytica para destruir monocapas celulares in vitro. CP1, CP2 y CP5 son las cisteín proteasas más abundantemente expresadas en E. histolytica, mientras que CP3 es la más abundante en E. dispar. Curiosamente, la sobreexpresión de CP2 en E. dispar aumentó la capacidad de los trofozoitos para destruir monocapas celulares in vitro. Sin embargo, la sobreexpresión de CP2 no condujo a la capacidad de E. dispar para formar abscesos hepáticos en los jerbos. Por lo tanto, no está claro los roles precisos que pueden desempeñar las proteasas en la patogénesis.
En resumen, la patogenia asociada con la infección por E. histolytica se debe principalmente a su capacidad para invadir tejidos y matar células huésped. Se han identificado varios factores de virulencia potenciales (ver Tabla). Sin embargo, no está claro el papel exacto que desempeñan estos diversos factores de virulencia en el desarrollo de la enfermedad invasiva. Un enfoque para comprender la patogenia es comparar estos factores de E. histolytica y E. dispar. Estas dos especies están estrechamente relacionadas y los factores de virulencia potenciales se encuentran en ambas especies. La adherencia, la actividad citolítica y la actividad proteolítica son características biológicas inherentes de ambas especies y estas actividades no conducen necesariamente a patología. Sin embargo, existen diferencias cualitativas y cuantitativas entre E. histolytica y E. dispar que pueden explicar las diferencias en la virulencia. Estas diferencias genéticas entre E. histolytica y E. dispar indican que la patogénesis es en parte una característica inherente del parásito. Sin embargo, la patogenia se debe probablemente a los efectos combinados de varios factores del huésped y del parásito, y la virulencia puede representar el grado en que el huésped puede controlar la invasión y replicación del trofozoíto.
[Ver Huston, 2004, Tr. Parasitol. 20:23 o Ralston y Petri, 2011, Tr. Parasitol. 27: 253 para revisiones sobre patogénesis.]
PRESENTACIÓN CLÍNICA
La amebiasis presenta una amplia gama de síndromes clínicos (Tabla) que refleja la posibilidad de que E. histolytica se vuelva invasiva y cause una enfermedad progresiva. El período de incubación puede variar desde unos pocos días hasta meses o años, siendo las más comunes 2-4 semanas. Pueden ocurrir transiciones de un tipo de síndrome intestinal a otro y las infecciones intestinales pueden dar lugar a infecciones extraintestinales.
La mayoría de los individuos diagnosticados con E. histolytica (o E. dispar) no presentan síntomas o tienen síntomas abdominales vagos e inespecíficos. Este estado puede persistir o progresar a una infección sintomática. Las infecciones sintomáticas no disentéricas presentan síntomas variables que van desde leves y transitorios hasta intensos y duraderos. Los síntomas típicos incluyen: diarrea, calambres, flatulencia, náuseas y anorexia. La diarrea alterna frecuentemente con períodos de estreñimiento o heces blandas. Las heces a veces contienen moco, pero no hay sangre visible.
La disentería amebiana generalmente comienza lentamente durante varios días con cólicos abdominales, tenesmo y heces sueltas ocasionales, pero progresa a diarrea con sangre y moco. La sangre, el moco y las piezas de tejido necrótico se hacen más evidentes a medida que aumenta el número de deposiciones (10-20 o más por día) y las deposiciones a menudo contendrán poca materia fecal. Algunos pacientes pueden presentar fiebre, vómitos, sensibilidad abdominal o deshidratación (especialmente en niños) a medida que aumenta la gravedad de la enfermedad. El colito fulminante o grangeno es una forma rara pero extremadamente grave de amebiasis intestinal. Los pacientes se presentan con diarrea sanguinolenta grave, fiebre y sensibilidad abdominal difusa. La mayor parte de la mucosa está afectada y la mortalidad supera el 50%. También puede ocurrir una amebiasis crónica, caracterizada por ataques recurrentes de disentería con períodos intermedios de síntomas gastrointestinales leves o moderados.
Los amebomas se presentan como masas abdominales dolorosas que ocurren con mayor frecuencia en el ciego y el colon ascendente. Los síntomas obstructivos o hemorragias también pueden estar asociados con un ameboma. Los amebomas son poco frecuentes y pueden confundirse con carcinomas o tumores. Las úlceras perianales son una forma de amebiasis cutánea que resulta de la propagación directa de la infección intestinal.
Los abscesos hepáticos amebianos son la forma más común de amebiasis extraintestinal. El inicio de los síntomas hepáticos puede ser rápido o gradual. Las infecciones hepáticas se caracterizan por hepatomegalia, sensibilidad al hígado, dolor en el cuadrante superior derecho, fiebre y anorexia. La fiebre a veces ocurre diariamente en la tarde o en la noche. Las pruebas de función hepática suelen ser normales o ligeramente anormales y la ictericia es inusual. Los abscesos hepáticos ocasionalmente se rompen en el peritoneo, lo que resulta en peritonitis.
|
Síndromes clínicos Asociado a la amebiasis |
|
Enfermedad intestinal quiste pasador asintomático
Enfermedad extraintestinal
|
La amebiasis pulmonar generalmente se debe a la extensión directa del absceso hepático a través del diafragma. Los síntomas clínicos con mayor frecuencia incluyen tos, dolor de pecho, disnea (dificultad para respirar) y fiebre. El esputo puede ser purulento o teñido de sangre y contener trofozoitos. También puede ocurrir una expectoración profusa (es decir, vómica) de material purulento. La metástasis primaria a los pulmones es rara, pero ocurre. De manera similar, la infección de otros órganos (p. Ej., Cerebro, bazo, pericardio) también es rara. Los síntomas clínicos están relacionados con el órgano afectado.
La amebiasis cutánea es el resultado de que la piel o las membranas mucosas se bañan en líquidos que contienen trofozoitos. Este contacto puede ser el resultado de una fístula (intestinal, hepática, perineal) o una invasión de los genitales. Las lesiones cutáneas tienen una superficie húmeda, granular, necrótica con bordes prominentes y pueden ser altamente destructivas. El diagnóstico clínico es difícil y generalmente se considera con factores de riesgo epidemiológicos (por ejemplo, áreas endémicas, homosexualidad masculina, etc.).
DIAGNÓSTICO, TRATAMIENTO Y CONTROL.
El diagnóstico definitivo de amebiasis requiere la demostración de quistes o trofozoítos de E. histolytica en heces o tejidos. Las muestras de heces deben conservarse, teñirse y examinarse microscópicamente. Los quistes tienden a predominar en las heces formadas y los trofozoítos en las heces diarreicas (ver morfología). Las heces frescas también pueden examinarse de inmediato para detectar trofozoitos móviles que exhiben una motilidad progresiva. La sigmoidoscopia puede revelar las úlceras características, especialmente en las enfermedades más graves. Los aspirados o biopsias también deben examinarse microscópicamente en busca de trofozoitos.
histolytica y E. dispar no se pueden distinguir en criterios morfológicos. Los kits de detección de antígenos están disponibles para la identificación positiva de estas especies. Una de estas pruebas de detección rápida de antígenos es laE. HISTOLYTICA QUIK CHEK (TechLab, Inc).
La serología es especialmente útil para el diagnóstico de amebiasis extraintestinal. Más del 90% de los pacientes con colitis invasiva y abscesos hepáticos exhiben anticuerpos séricos contra E. histolytica. Sin embargo, los anticuerpos pueden persistir durante años y distinguir infecciones pasadas y actuales puede plantear problemas en áreas endémicas. Se pueden usar técnicas de imagen no invasivas (p. Ej., Ultrasonido, tomografía computarizada, resonancia magnética) para detectar abscesos hepáticos. También es posible aspirar abscesos hepáticos. Sin embargo, esto rara vez se hace y solo se indica en casos seleccionados (p. Ej., Serología e imagen no disponibles, fines terapéuticos). El aspirado suele ser un líquido espeso de color marrón rojizo que rara vez contiene trofozoitos. Es más probable que se encuentren trofozoitos en la pared del absceso y no en los desechos necróticos en el centro del absceso.
Hay varios medicamentos disponibles para el tratamiento de la amebiasis y la elección del medicamento (s) depende de la etapa clínica de la infección (Tabla). El pronóstico después del tratamiento es generalmente bueno en casos no complicados. En los casos en los que se confirma E. histolytica o se desconoce la especie (es decir, dispar o histolytica), los quistes asintomáticos deben tratarse para prevenir la progresión a enfermedad grave y controlar la propagación de la enfermedad. Sin embargo, en muchas áreas endémicas, donde las tasas de reinfección son altas y el tratamiento es costoso, la práctica estándar es tratar solo los casos sintomáticos. Se recomienda el metronidazol o tinidazol (si está disponible) para todas las infecciones sintomáticas. Este tratamiento debe seguirse o combinarse con medicamentos antiamebicos lumenales como se describe para pacientes asintomáticos.
| Diagnóstico |
Enfermedad intestinal
Enfermedad extraintestinal (hepática)
|
| Tratamiento de la amebiasis | |
| Las drogas | Usos |
| Focoato de yodoquinol, paromomicina o diloxanida | Agentes luminales para tratar casos asintomáticos y como tratamiento de seguimiento después de un nitroimidazol. |
| Metronidazol o Tinidazol | Tratamiento de la colitis no disentérica, disentería e infecciones extraintestinales. |
| Dehydroemetine o Emetine | Tratamiento de enfermedades graves como colitis necrótica, perforación de la pared intestinal, rotura de absceso hepático. |
En los casos de colitis amémica fulminante o perforación de la pared intestinal, también se puede usar un antibiótico de amplio espectro para tratar bacterias intestinales en el peritoneo. La colitis necrótica requiere hospitalización urgente para restablecer el equilibrio de líquidos y electrolitos. Además, a veces se coadministran emetina o dehidroemetina con el nitroimidazol. Esto solo se hace en los casos más graves debido a la toxicidad de estos medicamentos. La cirugía también puede ser necesaria para cerrar perforaciones o una colostomía parcial. El drenaje de abscesos de lesiones hepáticas (es decir, aspiración con aguja o drenaje quirúrgico) rara vez se realiza con fines terapéuticos y solo está indicado en casos de abscesos grandes con una alta probabilidad de ruptura.
Las medidas de prevención y control son similares a otras enfermedades transmitidas por vía fecal-oral (ver Factores de riesgo o discusión sobre el control de Giardia). La principal diferencia es que los humanos son el único huésped de E. histolytica y no hay posibilidad de transmisión zoonótica. El control se basa en evitar la contaminación de los alimentos o el agua con material fecal. La educación para la salud en lo que respecta a la mejora de la higiene personal, la eliminación sanitaria de las heces y el lavado de manos son particularmente eficaces. Proteger los suministros de agua reducirá la endemicidad y las epidemias. Al igual que Giardia, los quistes de Entamoeba son resistentes al tratamiento con cloro estándar, pero son eliminados por yodo o por ebullición. Los procesos de sedimentación y filtración son bastante efectivos para eliminar los quistes de Entamoeba. No se recomienda la quimioprofilaxis.
Opiniones sobre la amebiasis:
Haque, R. et al (2003) Amebiasis. N. Engl. J. Med. 348: 1565.
Stanley, S.L. (2003) Amebiasis. The Lancet 361: 1025.
BLASTOCYSTIS HOMINIS
Blastocystis hominis es un organismo común que se encuentra en las heces humanas. Desde su descripción inicial hace aproximadamente 100 años, se ha clasificado de diversas maneras como ameba, levadura, esporozoo y la etapa de quiste de un flagelado. El análisis de la secuencia de ARNr de subunidades pequeñas indica que Blastocystis está más estrechamente relacionada con las estramenópilas, un conjunto complejo de protistas unicelulares y muticelulares. Otros stramenopiles incluyen diatomeas, algas pardas y mohos de agua. Muchas de las características de Blastocystis son desconocidas o controvertidas. El modo de transmisión, el mecanismo de replicación celular y otras características del ciclo de vida no se han demostrado de manera concluyente. De manera similar, el estado de Blastocystis como un organismo patógeno, comensal u oportunista es desconocido.
Blastocystis es polimórfico porque se encuentra una variedad de formas morfológicas en las heces y el cultivo in vitro. La forma más reconocida es el diámetro esférico de 10-15 µm con una gran vacuola central (Figura). Esta gran vacuola empuja los núcleos y otros orgánulos a la periferia de la célula. La vacuola a veces se llena con un material granular. Se han identificado pequeñas formas de quistes resistentes a partir de cultivos in vitro y ocasionalmente observadas en heces. Estos supuestos quistes miden aproximadamente 5 µm y están rodeados por una pared multicapa. Además, los quistes no se lisan cuando se colocan en agua, lo que sugiere que son resistentes a las condiciones ambientales. Presumiblemente Blastocystis se transmite a través de una vía fecal-oral. Sin embargo, esto no se ha demostrado de manera concluyente.
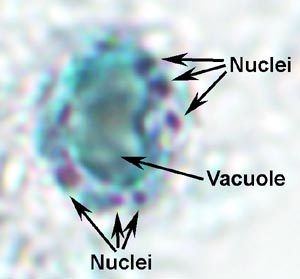
habido varios informes que sugieren que Blastocystis causa la enfermedad, así como muchos informes que sugieren lo contrario. La diarrea, los calambres, las náuseas, los vómitos y el dolor abdominal se han asociado con una gran cantidad de organismos en las heces. Además, algunos estudios han demostrado que el tratamiento alivia los síntomas y elimina los organismos. Sin embargo, los fármacos utilizados contra Blastocystis (por ejemplo, metronidazol) también funcionan contra muchos otros protozoos intestinales y bacterias. La incapacidad de descartar otros organismos como fuente de síntomas y la observación de que muchas personas infectadas no presentan síntomas hace que sea difícil sacar conclusiones definitivas sobre la patogenia de Blastocystis. Además, podría ser que Blastocystis sea principalmente un comensal, pero puede exhibir virulencia en condiciones específicas del huésped como infecciones concomitantes, mala nutrición o inmunosupresión.
Blastocystis también se encuentra en una amplia gama de animales, incluyendo mamíferos, aves, reptiles, anfibios e incluso insectos, y exhibe una amplia gama de diversidad molecular. La distancia genética entre los aislamientos de Blastocystis es mayor que la distancia genética entre E. histolytica y E. dispar (ver discusión sobre E. dispar). Esto complica la designación de especies y, históricamente, los aislamientos humanos se han designado como B. hominis y los aislamientos para otros hospedadores como Blastocytis sp .. Sin embargo, el análisis filogenético revela que no hay clados exclusivamente humanos y se encuentran aislamientos humanos en todos los clados. Esto plantea la posibilidad de que Blastocystis no sea específico del host y pueda transmitirse zoonóticamente. Además, la amplia gama de diversidad genética podría explicar la controversia sobre la patogenia de Blastocystis en que algunos genotipos pueden ser más virulentos que otros. Sin embargo, los estudios que abordan este tema sugieren que este no es el caso. La resolución de la confusión sobre la taxonomía, transmisión y virulencia de Blastocystis requerirá estudios adicionales.
Opiniones sobre Blastocystis:
- Clark CG, van der Giezen M, Alfellani MA, Stensvold CR (2013) Desarrollos recientes en la investigación de Blastocystis. Avances en Parasitología 82, 1-32.
- Scanlan PD (2012) Blastocystis: trampas pasadas y perspectivas futuras. Tendencias en Parasitología 28, 327-334.
- Tan KSW, Mirza H, Teo JDW, Wu B, MacAry PA (2010) Opiniones actuales sobre la relevancia clínica de Blastocystis spp. Informes actuales de enfermedades infecciosas 12, 28-35.
COMENSALES NO PATOGENICOS
Numerosos protozoos pueden habitar el tracto gastrointestinal de los humanos. La mayoría de estos muestran poca o ninguna patología manifiesta. La infección con estos protozoos es evidencia de contaminación fecal e indica un riesgo de infecciones más graves, como Giardia o E. histolytica. Estas especies no patógenas también pueden confundirse con la potencialmente patógena Giardia o E. histolytica y resultar en un tratamiento farmacológico innecesario. Además, este diagnóstico erróneo también es problemático, ya que la verdadera causa de los síntomas puede pasarse por alto y el tratamiento adecuado se retrasará.
- Otras Entamoeba
- Otras amebas intestinales
- Otros flagelados intestinales
- Blastocystis
Especies Entamoeba que infectan a los humanos
Varias especies de Entamoeba infectan a los humanos (caja). E. histolytica puede causar una enfermedad intestinal grave caracterizada por disentería, así como una enfermedad invasiva que afecta principalmente al hígado (ver Amebiasis). E. dispar es morfológicamente idéntica a E. histolytica, pero no produce una enfermedad invasiva (ver más información sobre E. dispar). Una característica distintiva de la Entamoeba es su morfología nuclear que se describe con cromatina periférica y un pequeño cariosoma. E. histolytica / dispar, E.coli y E. hartmanni se pueden distinguir por tamaño y diferencias morfológicas menores (ver Tabla).
|
Especies de Entamoeba Intestinal |
||
| E.dispar* | E.coli | E.hartmanni |
| Trophozoites | Trophozoites | Trophozoites |
|
15-20 µm ** extender pseudopodios movimiento progresivo |
20-25 µm pseudópodos de punta roma movimiento lento, no direccional |
8-10 µm menos progresivo que E. dispar |
| Cysts | Cysts | Cysts |
|
12-15 µm 4 núcleos cuerpos cromatoides romos |
15-25 µm 8 núcleos cuerpos cromatoides puntiagudos |
6-8 µm 4 núcleos cuerpos cromatoides romos CB persisten en los quistes maduros. |
coli es la más grande y se distingue mejor por 8 núcleos en el quiste maduro. Los trofozoitos de E. coli pueden ser difíciles de distinguir de E. histolytica / dispar, ya que existe cierta superposición en los rangos de tamaño. E. hartmanni es bastante similar a E. histolytica y anteriormente se consideraba una “pequeña raza” de E. histolytica. Generalmente se elige 10 µm como el límite entre E. histolytica y E. hartmanni.
polecki generalmente se asocia con cerdos y monos, pero en ocasiones se han documentado casos en humanos. Parece estar geográficamente restringido a áreas particulares como Papua, Nueva Guinea. Los trofozoitos son similares a E. coli, excepto un poco más pequeños, y los quistes son similares a E. histolytica, excepto que el quiste maduro tiene un solo núcleo.
E.gingivalis se puede recuperar del sarro blando entre los dientes y muestra una morfología similar a la de E. histolytica, excepto que no tiene una etapa de quiste. E. gingivalis también puede multiplicarse en el moco bronquial, y por lo tanto puede aparecer en el esputo. En este caso podría confundirse con E. histolytica de un absceso pulmonar. Los trofozoitos de E. gingivalis a menudo contienen leucocitos ingeridos que se pueden usar para diferenciarlos de E. histolytica. Los trofozoitos se recuperan con mayor frecuencia de pacientes con enfermedad periodontal, pero no se ha establecido una etiología entre el organismo y la enfermedad y se considera que E. gingivalis no es patógena.
Otras amebas intestinales
Otras amebas no patógenas incluyen Endolimax nana y Iodoamoeba bütschlii. Históricamente, Dientamoeba fragilis se ha agrupado con la ameba, pero la microscopía electrónica y la filogenética molecular sugieren que en realidad es un flagelado y puede estar estrechamente relacionada con las tricomonas (ver arriba). Los tres de estos organismos exhiben morfologías similares y tienen núcleos que no tienen cromatina periférica y un gran carosoma. Las diferencias morfológicas menores permiten distinguir estos organismos (Tabla).
|
Otras amebas intestinales |
||
| Endolimax nana | Iodamoeba bütschlii | Dientamoeba fragilis* |
| Trofozoitos | Trofozoitos | Trofozoitos |
| 8-10 µm | 12-15 µm |
8-10 µm a menudo bi-nucleado cariosoma fragmentado |
| Cysts | Cysts | Cysts |
|
6-8 µm 4 núcleos |
10-12 µm 1 núcleo vacuol de glucógeno |
sin quistes |
Otros flagelados intestinales
Otros cuatro flagelados no patógenos recuperados de heces humanas son: Trichomonas hominis, Chilomastix mesnili, Enteromonas hominis y Retortamonas intestinalis. Entre estos, T. hominis, también llamado Pentatrichomonas hominis, es el más común y con frecuencia se recupera de las heces diarreicas. Estos flagelados exhiben morfologías similares (Tabla) y pueden ser difíciles de distinguir. Los trofozoitos de todos estos flagelados tienen forma de lágrima y contienen un solo núcleo y el quiste tiende a ser ligeramente alargado u ovalado.
|
Otros flagelados intestinales |
|||||
| Size |
Trophozoites Flagella |
Size | cysts | ||
| Pentatrichomonas hominis | 6-14 µm | 4 anterior, | 1 posterior | Sin etapa quística | |
| Chilomastix mesnili | 10-15 µm | 4 anterior, | 4-7 µm | ||
| Enteromonas hominis | 6-8 µm | 3 anterior, | 1 posterior | 7-9 µm | |
| Retortamonas intestinalis | 4-10 µm | 1 anterior, | 1 posterior | 4-8 µm | |
